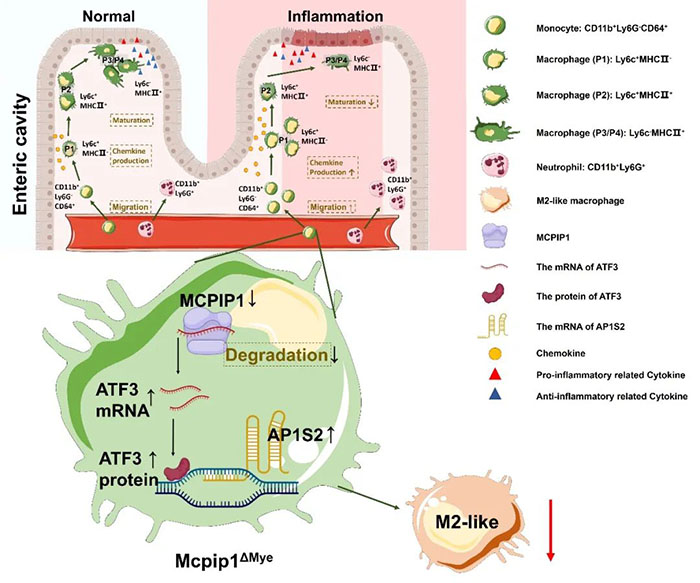
近日,同济大学刘占举团队在Gut杂志上发表了题为 MCPIP1 restrains mucosal inflammation by orchestrating the intestinal monocyte to macrophage maturation via an ATF3-AP1S2 axis 的研究论文。该论文聚焦于MCPIP1分子通过调控Atf3-Ap1s2信号通路,调控肠黏膜固有层单核-巨噬细胞成熟,从而限制肠黏膜炎症的过程。巨噬细胞主要来源于卵黄囊、胎肝和造血干细胞。生理状态下,外周血液循环中单核细胞表达高水平CCR2,由MCP-1(CCL2)趋化进入组织或淋巴结中,经过传统的分化过程(即P1、P2、P3、P4四个阶段)发育成熟为巨噬细胞并定植于肠道,进而发挥调节肠黏膜免疫稳态的作用。其中,主要由P3、P4阶段发育成熟的巨噬细胞发挥抗炎杀菌作用。当肠道炎症发生时,单核细胞分化成熟为巨噬细胞的过程受阻,滞留于P1/P2这一不成熟的阶段,产生大量促炎症细胞因子(如IL-1β、IL-6、TNF-α)和趋化因子(如CCL2、CCL3、CCL4)参与炎症扩大反应。研究还发现,成熟巨噬细胞具有高度可塑性和异质性,在不同的诱导条件下可向促炎(M1型)或抑炎(M2型)方向极化,发挥不同的生物学功能。因此,研究组织内单核细胞向巨噬细胞成熟过程及成熟巨噬细胞的极化状态,探究其可能存在的促进或阻滞因素,对于IBD黏膜免疫调控及其机制研究有着重要意义。首先,作者发现MCPIP1髓系细胞特异性敲除(Mcpip1∆Mye)小鼠出现多器官自发性炎症,在胃肠道系统主要表现为肠上皮屏障完整性损伤,免疫细胞在肠黏膜的大量浸润,髓系细胞向肠黏膜迁移能力的增加。此种小鼠来自中佛罗里达大学伯内特生物医学学院Pappachan E Kolattukudy教授及牛建立教授的实验室。通过DSS/TNBS构建小鼠急性结肠炎膜性,作者发现Mcpip1∆Mye小鼠出现更加严重的肠炎,表现为肠黏膜上皮结构破坏,肠黏膜中髓系细胞,特别是单核-巨噬细胞浸润增加,外周血迁移而来的单核细胞向巨噬细胞成熟过程受阻(P1群细胞占比增加,P3/P4群细胞占比降低),促炎细胞因子增多。为了进一步明确肠黏膜固有层中CD11b+ 髓系细胞的分群,作者分离了DSS造模后Mcpip1∆Mye小鼠及其对照组小鼠肠黏膜固有层中的CD11b+ 细胞,通过单细胞测序分析,发现单核-巨噬细胞可以进一步分为5群。根据每群细胞特征,发现Mcpip1∆Mye小鼠肠黏膜中,有2群属于P1的细胞群占比增多;2群细胞属于P2细胞群;另有1群属于P3/P4的细胞群占比降低。此外,作者还通过单细胞测序发现Ccr2+Il-1β+Tlr2+Cx3cr1−Cd163−Mrc1−Ly6c+细胞群具有明确的促炎特征,这可能是Mcpip1∆Mye小鼠炎症加重的重要原因。此后,作者通过RNA测序与单细胞测序数据进行对比,并结合RIP-seq数据进行分析,发现了巨噬细胞中MCPIP1特异性敲除能够引起Atf3,Ap1s2等分子表达水平增加。Luciferase实验、CUT&TAG实验及Western blot实验表明,Atf3蛋白可以通过结合于Ap1s2分子的启动子区域,促进其表达水平上升,而此信号通路受到MCPIP1的抑制。通过体外抑制BMDMs中Atf3和Ap1s2的表达,作者发现巨噬细胞向M2方向极化增加,迁移能力降低;通过体内抑制Ap1s2的表达,发现Mcpip1∆Mye小鼠肠炎相对减轻,表现为髓系细胞浸润减少,原有的单核细胞向巨噬细胞成熟受阻状态得到缓解(P1群细胞占比减少,P3/P4群细胞占比增加)。此外,作者收集IBD患者及健康贡献者外周血CD14+ 细胞和肠黏膜,通过PCR检测及免疫荧光染色等实验发现,患者MCPIP1表达水平增加,这可能提示该分子在患者体内呈适应性增加状态,并存在对自身的负反馈调控。体外将CD14+细胞培养为巨噬细胞,然后抑制Atf3和Ap1s2的表达,同样能够发现巨噬细胞向M2方向极化增加,这提示抑制Atf3-Ap1s2信号通路具有抑制炎症进展,促进免疫稳态调控的作用。总之,这项工作强调了巨噬细胞在肠黏膜免疫中的重要作用,创新性提出了MCPIP1可以通过下调Atf3-Ap1s2信号通路,发挥抑制炎症的作用。该研究揭示了Ap1s2作为分子靶点的可能性,为IBD的临床诊疗提供了新思路。同济大学、同济大学附属上海市第十人民医院刘占举教授为该论文通讯作者。同济大学医学院、同济大学附属上海市第十人民医院吕慧颖博士、张萃博士、吴维博士为该论文共同第一作者。该工作还获得了同济大学朱瑞新教授、中佛罗里达大学伯内特生物医学学院Pappachan E Kolattukudy教授、牛建立教授的大力支持。
原文链接:
https://doi:10.1136/gutjnl-2022-327183